A semente de peixe é o componente mais importante para a piscicultura. Os recursos de água doce do nosso país para a piscicultura são estimados em 2,85 milhões de hectares de lagoas e tanques. Além disso, outros 2,05 milhões de hectares de área de água estão disponíveis na forma de reservatórios ou lagos. Estima-se que cerca de 14.250 milhões de alevinos seriam necessários para o estoque, mesmo os atuais 2,85 milhões de hectares disponíveis em uma taxa de lotação conservadora de 5.000 alevinos / ha. A produção atual é de 1.5007 milhões de alevinos. Além disso, pelo menos uma quantidade adicional de 4100 milhões de alevinos são necessários para estocar a área disponível de lagos e reservatórios com uma taxa média de lotação de 2000 alevinos / ha. Isso indica que há necessidade de aumentar os alevinos para estocar os recursos hídricos disponíveis.
A semente do peixe é obtida de três fontes - ribeirinha, incubatórios e incubatórios. A coleta de sementes de nascente ribeirinha era uma prática milenar. Este método é extenuante e obtemos a mistura de sementes de peixes desejadas e indesejadas. Os incubatórios são a melhor forma de obter sementes de peixes. Além destes, a criação de bundh também é um bom método para coletar as sementes dos peixes criando um habitat natural.
Os diferentes sistemas fluviais da Índia apresentam variações no que diz respeito à distribuição e abundância de sua fauna de peixes. Isso se deve principalmente às suas condições ecológicas individuais, como gradiente, terreno, fluxo, profundidade, temperatura, substrata, etc. Os rios do norte são perenes e sustentam uma rica pesca comercial. Exceto para as regiões deltaicas, a pesca nos rios peninsulares é precária tanto no curso superior como no médio.
1 eu n du c e d B r eed eu n g T e c h não eu o g y
As carpas se reproduzem em águas correntes como rios. Naturalmente, eles nunca se reproduzem em águas confinadas. A semente coletada de recursos naturais é geralmente um estoque misto com variedades desejáveis e indesejáveis. A separação da semente desejável do estoque misto é um grande problema. Devido ao manuseio, as variedades desejáveis podem morrer. Se alguma semente de peixe predador for encontrada, eles prejudicam as sementes de peixes desejáveis. Outro grande problema é nunca obter o número exigido na coleção natural. A disponibilidade de sementes puras é muito difícil. Para superar todos esses problemas, a reprodução induzida é uma excelente técnica para obter sementes de peixes puras e necessárias. Tem várias vantagens. Com a reprodução induzida, sementes puras de espécies desejáveis podem ser obtidas. Suponha que a semente rohu seja necessária, apenas a semente rohu pode ser produzida em alguns dias. O número necessário de sementes pode ser produzido com esta técnica. Suponha que uma fazenda de peixes precise de 1 crore de semente de peixe, este número pode ser produzido muito facilmente em menos tempo. Os problemas de identificação e segregação de sementes não surgem. Essa técnica é muito simples. Sementes saudáveis podem ser produzidas. Os peixes podem ser reproduzidos mais de uma vez em um ano. A hibridização é possível.
Em técnicas de reprodução induzida, quatro tipos principais de materiais são usados para dar injeções em peixes - extrações da glândula pituitária, HCG, ovaprim e ovatide.
Ind você ce d Breedin g sagacidade h Pi t uitar y Glan d Extr uma ctio n
A criação de peixes por extração da glândula pituitária é uma maneira eficaz e confiável de obter sementes puras de peixes cultiváveis e é praticada hoje em uma escala bastante extensa na Índia, bem como em muitos outros países do mundo. Envolve a injeção de extratos de glândulas pituitárias de outros peixes maduros em peixes machos e fêmeas maduros.
H istori c uma eu Voltar g volta:
O conceito atual do papel da hipófise na reprodução de vertebrados é relatado como tendo se originado dos experimentos de Aschheim e Zondek em 1927, quando eles descobriram que os implantes hipofisários aceleravam o desenvolvimento sexual de camundongos fêmeas. Três anos depois, em 1930, Houssay, da Argentina, realizou o primeiro experimento desse tipo em um peixe. Ele injetou um pequeno bagre vivíparo, Cresterodon decammaculatus com extratos da glândula pituitária preparados a partir de outro peixe, Prochilodus platensis ocasionando o nascimento prematuro de jovens em desenvolvimento. Em 1934, uma técnica bem-sucedida pôde ser desenvolvida por Von Ihring em que certos peixes de lago brasileiros foram criados para desovar injetando-lhes uma suspensão de glândulas pituitárias frescas coletadas de outras espécies menos valiosas de peixes. Os brasileiros, portanto, foram os primeiros a usar a técnica de criação de peixes com sucesso por meio da hipofisação. Em 1937, O cientista russo Gerbiskii conseguiu induzir um número significativo de esturjões, Acipenser stellatus.
A Índia é o terceiro país do mundo a tornar a técnica parte integrante de seu programa de piscicultura. A primeira tentativa de hipofisação na Índia foi feita por Hamid Khan em 1937, quando ele tentou induzir a desova de Cirrhinus mrigala pela injeção da glândula pituitária de mamífero. A próxima tentativa foi feita por Hussain em 1945 com certos hormônios como 80-120 RV Prolan e Antuitrin-S em fêmeas de Labeo rohita e Cirrhinus mrigala. Em 1955, Hiralal Choudhuri conseguiu induzir a desova de Esomus danricus por injeção intraperitoneal de extrato hipofisário de Catla catla. Ele também teve sucesso na criação de Pseudotropius atherinoides. Ramaswamy e Sunderaraj tiveram sucesso na reprodução de Heteropneustes fossilis e Clarias batrachus em 1955 e 1956, respectivamente. O primeiro sucesso na criação induzida de carpas indianas principais por meio da hipofisação foi alcançado em 1957 por Hiralal Chaudhuri e Alikunhi no CIFRI, Cuttack.
Fis h P eu tuit uma r y Gla n d :
A glândula pituitária dos peixes é uma pequena, corpo macio e de cor branca cremosa. É mais ou menos redondo em carpas. Situa-se no lado ventral do cérebro (Fig. 3.1) atrás do quiasma óptico em uma concavidade do chão da caixa do cérebro, conhecido como Sella turcica e envolvido por uma fina membrana chamada duramater. Em alguns peixes, ele está ligado ao cérebro por um caule fino, conhecido como haste infundibular. Com base na haste infundibular, as glândulas são classificadas em dois tipos, nomeadamente, platibásico - sem haste, tem um recesso infundibular aberto e leptobásico - com pedúnculo, têm recesso infundibular obliterado. O tipo leptobásico de glândulas pituitárias é encontrado em carpas e o tipo platibásico em channidae e nandidae. O tamanho e o peso da glândula variam de acordo com o tamanho e o peso do peixe. Em Labeo rohita, o peso médio da glândula pituitária é de 6,6 mg em peixes de 1-2 kg, 10,3 mg em peixes de 2-3 kg, 15,2 mg em peixes de 3-4 kg e 18,6 mg em peixes de 4-5 kg.
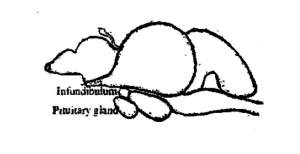
A glândula pituitária secreta os hormônios gonadotrópicos, FSH ou hormônio estimulante folicular, e LH ou hormônio luteinizante. Ambos os hormônios são secretados ao longo do ano, mas a proporção em que são secretados está diretamente correlacionada com o ciclo de maturidade gonadal. O FSH causa o crescimento e a maturação dos folículos ovarianos nas mulheres e a espermatogênese nos testículos dos homens. O LH ajuda a transformar os folículos ovarianos em corpo lúteo nas mulheres e a promover a produção de testosterona nos homens. Esses hormônios não são específicos da espécie, ou seja, um hormônio obtido de uma espécie é capaz de estimular as gônadas de outro peixe. Contudo, há grande variabilidade em sua eficácia em diferentes espécies. Os experimentos conduzidos na criação induzida de peixes mostraram claramente a eficácia relativa dos extratos da hipófise de peixes sobre os hormônios da hipófise de mamíferos. hormônios sexuais e vários esteróides. Esta é a razão pela qual a pituitária de peixes está sendo amplamente utilizada hoje em dia em trabalhos de criação de peixes em todo o mundo.
Collecti o n o f Pituitar y Glândula :
Os peixes doando a glândula pituitária, ou seja, o peixe do qual a glândula pituitária é coletada é chamado de peixe doador. O sucesso na criação induzida de peixes depende em grande parte da seleção adequada dos peixes doadores. A glândula deve ser preferencialmente coletada de peixes grávidos totalmente maduros, já que a glândula é mais potente no momento da reprodução ou imediatamente antes da desova. A potência da glândula diminui após a desova. Glândulas coletadas de peixes imaturos ou exaustos geralmente não dão resultados satisfatórios. Glândulas em peixes de criação induzida coletadas imediatamente após a desova também se mostraram eficazes e podem ser usadas para a criação de outros peixes. A época mais adequada na Índia para a coleta das glândulas pituitárias das principais carpas é durante os meses de maio a julho, já que a maioria das carpas atinge estágios avançados de maturidade durante este período. Desde a carpa comum, Cyprinus carpio é um criador perene, seus indivíduos maduros podem ser obtidos quase todo o ano para a coleta de glândulas. As glândulas são geralmente preferidas para serem coletadas de peixes recém-mortos, mas aquelas coletadas de espécimes preservados em gelo também são usadas.
Diversas técnicas são adotadas para a coleta das glândulas pituitárias em diferentes países. Na Índia, a técnica comumente adotada de coleta de glândulas é cortar o couro cabeludo do crânio do peixe com um golpe oblíquo de uma faca de açougueiro. Depois que o couro cabeludo é removido, a massa cinzenta e as substâncias gordurosas que ficam sobre o cérebro são cuidadosamente limpas com um pedaço de algodão. O cérebro assim exposto é cuidadosamente retirado ao separá-lo dos nervos. Na maioria dos ciprinídeos, quando o cérebro é levantado, a glândula é deixada para trás no chão da caixa do cérebro. A dura-máter que cobre a glândula é então cuidadosamente removida usando uma agulha fina e uma pinça. A glândula exposta é então pega intacta sem causar nenhum dano a ela porque glândulas danificadas e quebradas resultam em perda de potência.
As glândulas também são coletadas através do forame magno. Isto é, na verdade, um método muito mais fácil de remoção da glândula que é comumente praticado pelos profissionais para coleta em grande escala em mercados de peixes lotados e barulhentos. Neste método de coleta de glândula, o peixe deve ser essencialmente decapitado. Nos mercados, glândulas são coletadas de cabeças de peixes já cortadas pelos varejistas. Nas cabeças de peixe cortadas, o forame pode ser visto claramente por trás, contendo matéria cinzenta e substâncias gordurosas. O cérebro fica nas laterais ventrais do forame. Para tirar a glândula, a massa cinzenta e as substâncias gordurosas são removidas primeiro inserindo a extremidade romba da pinça no forame e retirando toda a matéria sem perturbar o cérebro. O cérebro é levantado com cuidado e empurrado para a frente ou puxado para fora do buraco. A glândula que está no chão da caixa do cérebro é então apanhada com uma pinça fina. Um trabalhador experimental consegue facilmente coletar cerca de 50-60 glândulas em uma hora, adotando esta técnica de coleta.
P reserva o f Pituit uma r y Glândula s :
Se as glândulas coletadas não se destinam ao uso naquele momento, eles devem ser preservados. Devido à sua natureza de glicoproteína ou mucoproteína, são passíveis de ação enzimática imediata. As glândulas pituitárias podem ser preservadas por três métodos - álcool absoluto, acetona e congelamento. A preservação da glândula pituitária de peixes em álcool absoluto é preferida na Índia. Além disso, experimentos feitos até agora com glândulas preservadas em álcool em carpas indianas deram resultados mais positivos do que com glândulas preservadas em acetona.
As glândulas após a coleta são imediatamente colocadas em álcool absoluto para desengorduramento e desidratação. Cada glândula é mantida em um frasco separado, marcado em série para facilitar a identificação. Após 24 horas, as glândulas são lavadas com álcool absoluto e mantidas novamente em álcool absoluto fresco contido em frascos de cor escura e armazenados em temperatura ambiente ou no refrigerador. A troca ocasional de álcool ajuda a manter as glândulas em boas condições por períodos mais longos. Para evitar que a umidade entre nos frascos, eles podem ser mantidos dentro de um dessecador contendo um pouco de cloreto de cálcio anidro. É preferível manter as glândulas na geladeira. Eles podem ser armazenados na geladeira por até 2 a 3 anos e em temperatura ambiente por até um ano.
A acetona também é um bom conservante. Neste método, logo após a coleta, as glândulas são mantidas em acetona fresca ou em acetona resfriada em gelo seco dentro de um refrigerador a 100 ° C por 36-48 horas. Durante este período, a acetona é trocada 2-3 vezes em intervalos de cerca de 8-12 horas para desengorduramento e desidratação adequados. As glândulas são então retiradas da acetona, colocar em um papel de filtro e deixar secar em temperatura ambiente por uma hora. Eles são então armazenados em uma geladeira a 100 C, preferencialmente em um dessecador carregado com cloreto de cálcio ou qualquer outro agente secante. A preservação de glândulas em acetona é amplamente praticada na URSS e nos EUA.
P reparação o f Pituita r y Gl uma n d E extrair :
As glândulas preservadas são então pesadas. Isso é essencial para a determinação precisa da dose a ser administrada de acordo com o peso dos criadores. O peso da glândula pode ser medido individualmente ou em grupo. Para obter um peso mais preciso, uma glândula deve ser pesada exatamente dois minutos após sua remoção do álcool.
O extrato de hipófise deve ser preparado um pouco antes do momento da injeção. A quantidade de glândula necessária para a injeção é inicialmente calculada a partir do peso do criador a ser injetado. As glândulas são então selecionadas e a quantidade necessária de glândulas é retirada dos frascos. O álcool pode evaporar, se as glândulas são preservadas em álcool. As glândulas secas com acetona são retiradas imediatamente dos frascos para maceração.
As glândulas são então maceradas em um homogeneizador de tecido pela adição de uma quantidade medida de água destilada ou solução de sal comum ou qualquer solução fisiológica que seja isotônica com o sangue do peixe receptor. Os resultados mais bem-sucedidos de reprodução induzida nas carpas principais indianas até agora foram obtidos com água destilada e 0,3% de solução de sal comum. A concentração do extrato é geralmente mantida na faixa de 1-4 mg de glândula por 0,1 ml da mídia, ou seja, a uma taxa de 20-30 g. da glândula em 1,0 ml da mídia. Após a homogeneização, a suspensão é transferida para um tubo de centrifugação. Durante a transferência, o homogenato deve ser bem agitado de modo que as partículas da glândula que estão sendo misturadas com a solução entrem no tubo de centrífuga. O extrato no tubo é centrifugado e o fluido sobrenadante é colocado em uma seringa hipodérmica para injeção.
O extrato de hipófise também pode ser preparado a granel e preservado em glicerina (1 parte do extrato:2 partes de glicerina) antes da estação de reprodução dos peixes, para evitar o incômodo de preparar o extrato todas as vezes antes da injeção. O extrato de caldo deve ser sempre armazenado em geladeira ou gelo.
T e c h Niq você e o f B ree d ing :
A operação de reprodução induzida de carpas principais é iniciada quando as monções regulares começam, os peixes amadurecem e a temperatura da água desce. Mulheres dando uma rodada, abdômen macio e protuberante com ventilação avermelhada e inchada e machos com milt escorrendo livremente são selecionados para reprodução. Um reprodutor macho também pode ser facilmente distinguido pela aspereza na superfície dorsal de suas barbatanas peitorais.
1 . Fazer s ag e o f pitui t ar y extr uma c t :
O aspecto mais importante da criação induzida de peixes é a avaliação das dosagens adequadas do extrato hipofisário. A potência da glândula varia de acordo com o tamanho e os estágios de desenvolvimento sexual do doador, bem como as espécies do peixe doador, tempo de coleta das glândulas e sua correta preservação. A dose da glândula pituitária é calculada em relação ao peso dos reprodutores a serem injetados. Também foi notado que doses idênticas para criadores de pesos semelhantes podem dar resultados contraditórios devido à diferença na maturidade das gônadas. Mesmo doses pesadas de hormônios podem não ser eficazes se as gônadas estiverem no estágio de reabsorção. Por meio da seleção cuidadosa dos criadores e da administração de um peso conhecido de extrato da glândula pituitária por kg de peso corporal dos criadores, a reprodução bem-sucedida pode ser obtida.
Experimentos de padronização de doses indicam que a administração de uma dose baixa preliminar em fêmeas reprodutoras, seguida de uma dose efetiva mais elevada após 6 horas, provou ser mais bem-sucedida do que uma única dose nocaute. Descobriu-se que uma única dose alta é útil quando os criadores estão em condições ideais e o clima é favorável. Rohu responde bem a duas injeções, enquanto catla e mrigal a uma e duas injeções.
Uma dose inicial de 2-3 mg. da glândula pituitária por kg de peso corporal dos peixes é administrado apenas às fêmeas reprodutoras. Criadores machos não requerem nenhuma dose inicial, se exsudam mofo com uma leve pressão no abdômen. Dois machos contra cada fêmea formam um conjunto de reprodução. Para fazer um bom conjunto de correspondência, o peso dos machos juntos deve ser igual ou maior do que o da fêmea. Caso a condição de qualquer um dos dois machos não seja encontrada no estágio de exsudação livre, uma injeção inicial pode ser administrada ao homem a uma taxa de 2-3 mg / kg de peso corporal. Após 6 horas, uma segunda dose de 5-8 mg / kg de peso corporal é dada à mulher, enquanto ambos os machos recebem a primeira ou a segunda dose a uma taxa de 2-3 mg / kg de peso corporal. Pequenas alterações nas doses podem ser feitas dependendo da condição de maturidade dos criadores e dos fatores ambientais prevalecentes. Na ausência de um equilíbrio químico, 1-3 glândulas pituitárias são eficazes para um par de peixes.
2 . M e no entanto d o f injeção :
As injeções intra-cranianas são preferidas na URSS e intra-peritoneais nos EUA e Japão. A injeção intramuscular é a prática mais comum na Índia. A injeção intramuscular é menos arriscada em comparação com os outros mehtods. As injeções intra-peritoniais são geralmente administradas nas regiões moles do corpo, geralmente na base da nadadeira pélvica ou às vezes na base da nadadeira peitoral. Mas existe o risco de danificar os órgãos internos, especialmente as gônadas distendidas ao administrar uma injeção intra-peritonial em peixes totalmente maduros.
As injeções são geralmente administradas no pedúnculo caudal ou nas regiões do ombro perto da base da nadadeira dorsal. Ao dar injeções nas carpas, a agulha é inserida sob uma escala mantendo-a paralela ao corpo do peixe no início e então perfurada no músculo em um ângulo. Não existe uma regra rígida e rápida quanto ao momento da injeção. As injeções podem ser administradas a qualquer hora do dia e da noite. Mas, uma vez que a baixa temperatura é útil e a noite permanece comparativamente mais silenciosa, as injeções são geralmente administradas no final da tarde ou à noite, com horários
Semente Produção T ecnologias 33
tão ajustado que o peixe é capaz de usar a quietude da noite para a desova sem ser perturbada.
A seringa hipodérmica mais conveniente usada para esse propósito é uma seringa de 2 cc com graduações de divisão de 0,1 cc. O tamanho da agulha da seringa depende do tamanho dos reprodutores a serem injetados. A agulha nº 22 é convenientemente usada para carpas de 1-3 kg, No. 19 para carpas maiores e No. 24 pode ser usado para carpas menores.
O uso de anestésicos durante a injeção aumentaria significativamente a sobrevivência dos peixes reprodutores. Os anestésicos comumente usados são MS 222 e Quinaldine. MS 222 pode ser adicionado à água em doses de 50-100 mg / litro. Um rolo de algodão embebido em 0,04 M desta solução pode ser inserido na boca do peixe. A quinaldina é usada na taxa de 50-100 mg / litro.
3 . B reedin g h ap uma um d spa C ning :
Após a injeção, os criadores são liberados imediatamente dentro do hapa de criação. Um hapa de reprodução é geralmente feito de tecido fino no tamanho de 3,5 x 1,5 x 1,0 m para criadores maiores e 2,5 x 1,2 x 1,0 m para criadores com peso inferior a 3 kg. Todos os lados do hapa de criação são costurados e fechados, exceto uma parte na parte superior para introdução dos criadores em seu interior. Geralmente, um conjunto de criadores é liberado dentro de cada hapa de criação, mas às vezes, a fim de economizar material hipofisário, a criação comunitária também é tentada reduzindo o número de criadores machos. Após a liberação do peixe, a abertura do hapa é fechada com segurança para que os criadores não possam pular e escapar. Em vez de hapas, cisternas de cimento ou piscinas de plástico do tamanho de hapas também podem ser usadas para reprodução.
A desova normalmente ocorre dentro de 3-6 horas após a segunda injeção. Logo após a fertilização, os ovos incham consideravelmente devido à absorção de água. Os ovos fertilizados de carpas grandes parecem contas de vidro brilhantes de transparência cristalina, enquanto os não fertilizados parecem opacos e esbranquiçados. O tamanho dos ovos da mesma espécie de criadores diferentes varia consideravelmente. Ovos totalmente inchados das carpas principais indianas medem 2,5 mm de diâmetro, o maior sendo o de catla e o menor de rohu. Os ovos da carpa são do tipo não flutuante e não adesivo. A gema não possui glóbulo de óleo. As principais carpas indianas têm uma grande capacidade de postura de ovos. Sua fecundidade, em média, é 3,1 lakh em rohu, 1-3 lakh em catla e 1,5 lakh em mrigal.
Os ovos em desenvolvimento são retidos no hapa de reprodução sem serem perturbados por um período de pelo menos 4-5 horas após a desova para permitir que os ovos sejam devidamente endurecidos em água. Depois disto, os ovos são coletados do hapa com o auxílio de uma caneca e transferidos para um balde com um pouco de água. Os criadores são então retirados e pesados para descobrir a diferença antes e depois da desova. Isso dá uma ideia da quantidade de ovos postos. O volume total e o número de ovos podem ser facilmente calculados a partir do volume conhecido e do número de ovos da caneca de amostra. A porcentagem de ovos fertilizados também é avaliada de acordo com a realização de amostragem aleatória antes e depois da desova. Isso dá uma ideia da quantidade de ovos postos. O volume total e o número de ovos podem ser facilmente calculados a partir do volume conhecido e do número de ovos da caneca de amostra. A percentagem de ovos fertilizados também é avaliada em conformidade através da realização de uma amostragem aleatória.
4 . S tri p alfinete g :
As carpas chinesas, no entanto, não desovam naturalmente e quando desovam, a porcentagem de fertilização é geralmente muito baixa. A remoção (Fig. 3.1) ou a inseminação artificial são, portanto, seguidas. A fêmea é segurada com a cabeça inclinada para cima e a cauda para baixo e a barriga voltada para o navio, e os ovos são coletados em um cocho de esmalte ou plástico pressionando o corpo da fêmea. O peixe macho é então segurado da mesma forma e o leite é espremido na mesma gamela. Os gametas são então misturados o mais rápido possível por meio de uma pena de pena para permitir a fertilização. Os ovos fertilizados são então lavados algumas vezes com água limpa para remover o excesso de leite e deixados sem serem perturbados em água doce por cerca de 30 minutos. Os ovos estão prontos para serem liberados nos tanques de incubação.

T e chn eu qu e o f h uma tch eu n g t h e e ggs :
Os ovos coletados das hapas reprodutoras são transferidos para as hapas incubadoras. Um hapa de incubação consiste em duas peças separadas de hapas, o hapa externo e o hapa interno. O hapa interno é menor em tamanho e é encaixado dentro do hapa externo. O hapa externo é feito de um tecido fino no tamanho padrão de 2 x 1 x 1 m, enquanto o hapa interno é feito de tecido de rede mosquiteira de malha redonda na dimensão de 1,75 x 0,75 x 0,5 m. Todos os cantos dos hapas externos e internos são fornecidos com laços e cordas para facilitar a instalação. Cerca de 75, 000 para 1, 00, 000 ovos são espalhados uniformemente dentro de cada hapa interno. Os ovos eclodem em 14-20 horas em uma faixa de temperatura de 24-310 C. O período de incubação, na verdade, é inversamente proporcional à temperatura. Após a incubação, os filhotes escapam para o hapa externo através das malhas do hapa interno. O hapa interno contém as cascas dos ovos e os ovos mortos que são removidos quando a incubação está completa. Os filhotes permanecem em hapa externo sem serem perturbados até o terceiro dia após a eclosão. Durante este período, eles subsistem com os alimentos armazenados em seu saco vitelino. No terceiro dia, a boca está formada e os filhotes começam o movimento diretivo e a alimentação. Nesse estágio, eles são cuidadosamente coletados do hapa externo de incubação e estocados em viveiros preparados.
Verificou-se que as carpas principais indianas podiam ser induzidas a desovar duas vezes na mesma estação, com um intervalo de dois meses. Os reprodutores após a primeira desova são alimentados com torta de amendoim e farelo de arroz na proporção de 1:1 a 2,5 por cento do peso corporal. Quando ocorrem condições climáticas favoráveis, eles amadurecem e estão prontos para a desova.
No d uce d Br e edin g C eu t h H.C. G .
Hoje a extração da glândula pituitária é uma técnica bem estabelecida para reprodução induzida em todo o mundo. Seu uso em larga escala apresenta os seguintes problemas no que diz respeito à disponibilidade e qualidade da glândula pituitária (P.G). Fornecimento inadequado de P.G., alto custo, variabilidade na potência da gonadotrofina hipofisária e trapaça por P.G. inescrupuloso. fornecedores. Para superar esses problemas, Gonadotrofina Coriônica Humana (H.C.G) foi encontrada como uma alternativa para a glândula pituitária. H.C.G. foi descoberto no início de 1927 por Aschheim e Zondek. Eles extraíram hormônio de boa qualidade com atividade gonadotrófica luteinizante da urina de mulheres grávidas. Os trabalhadores russos usaram a gonadotrofina coriônica pela primeira vez em 1964, com o nome comercial de Choriogohin, e obtiveram bons resultados com Loach. Bratanor (1963) e Gerbilski (1965) usaram o H.C.G em carpas e trutas e alcançaram grande sucesso. Tang (1968) afirmou que quando as carpas chinesas foram tratadas com pituitária de peixe em combinação com C.G., a eficácia na reprodução induzida aumentou. Uma leitura da literatura indica que H.C.G. é eficaz sozinho ou em combinação com P.G. extrato na indução de vários peixes em todo o mundo.
H.C.G. é uma glico-proteína ou sialo-proteína, por causa das moléculas de carboidratos ligadas às moléculas de proteína. Sua função primária é manter a produção de estrogênio e progesterona pelo corpo lúteo. É produzida pela placenta e excretada pela urina durante os primeiros estágios da gravidez (2-4 meses). H.C.G compreende 2 subunidades a e b e tem um tamanho molecular de 45, 000-50, 000 daltons. Existem 17 aminoácidos nele, da qual alanina, prolina, serina, cistina e histidina são importantes. Devido ao grande número de aminoácidos, H.C.G. tem um alto teor de proteína. O peso molecular foi relatado como 59, 000 por filtração em gel e 47, 000 por equilíbrio de sedimentação.
Durante os primeiros estágios da gravidez H.C.G. é rico na urina de mulheres grávidas. Vários métodos são empregados para a extração de H.C.G. Aschheim e Zondek (1927) usaram etanol para precipitação. Katzman e Caina usaram diferentes absorventes. A extração comercial de H.C.G em bruto é feita com filtração em gel.
O hormônio folículo estimulante (FSH) e o hormônio luteinizante (LH) da pituitária desempenham um papel importante na reprodução normal de peixes, isto é, na promoção do desenvolvimento de gônadas, crescimento, maturidade e desova. H.C.G é mais ou menos semelhante em caráter e função a F.S.H e L.H. Como a glândula pituitária é usada para reprodução induzida de peixes, H.C.G também pode ser usado para o amadurecimento precoce das gônadas. A superioridade de H.C.G sobre P.G pode ser medida com base nos seguintes fundamentos. O peixe atinge a maturidade mais rápido com H.C.G., a desova da época de reprodução pode ser aumentada com H.C.G., H.C.G. garante melhor sobrevivência da desova, reduz o intervalo de tempo entre as doses preparatórias e finais, H.C.G é mais econômico e tem uma longa vida útil, H.C.G está facilmente disponível em uma fonte padrão, portanto, é mais confiável, injeções periódicas de H.C.G ao longo do ano garantem melhor saúde e aumento de peso e desenvolvimento gonadal. A potência de H.C.G é conhecida (30 IU / mg), disponível em pacotes organizados de pesos conhecidos, nenhuma preservação está envolvida, não pode ser espúrio, Os peixes tratados com H.C.G podem ser usados mais de uma vez para reprodução induzida na mesma temporada, a taxa de mortalidade de filhotes é insignificante, o consumo da droga é menor durante os cruzamentos induzidos, O H.C.G pode ser usado como hormônio do crescimento e a absorção de ovos no final da estação de reprodução é comparativamente menor pela administração de H.C.G.
O H.C.G bruto está na forma de pó e na cor branca acinzentada ou amarelo claro. Dissolve-se facilmente na água. A quantidade calculada de H.C.G em bruto é colocada num homogeneizador de tecidos e agitada durante 5-10 minutos com água destilada medida. É centrifugado por 3-5 minutos. O líquido sobrenadante amarelo claro claro contendo os hormônios H.C.G é tomado e injetado imediatamente. Qualquer atraso no uso resultará na perda de potência.
No caso da carpa prateada (Hypophthalmichthyes molitrix), o uso de H.C.G é considerado bem-sucedido. A dosagem é de 4-6 mg / kg. peso corporal do homem, e 6-8 mg / kg de peso corporal da primeira dose e após cerca de 6-7 horas, 10-12 mg / kg de peso corporal da segunda dose para mulheres que deram bons resultados. O uso de apenas H.C.G na criação de carpas principais indianas não deu resultados bem-sucedidos até agora. Uma combinação de 60-80% H.C.G e 40-20% P.G para carpas e carpas principais indianas (Ctenopharyngodon idella) é bem-sucedida. Os peixes que são induzidos a procriar apenas com H.C.G são salmonetes, Cyprinus carpio, Lctalurus punctatus, Oreochromis nilotica, Aristichthys nobilis, Misgurnus fossilis, Esox lucius e Epinephelus tauvina.
Trabalhos recentes mostram que a combinação de H.C.G e P.G. é mais recomendável do que H.C.G ou P.G sozinho. Mais trabalho precisa ser feito para padronizar a dosagem de H.C.G para reprodução induzida de carpas principais e carpas chinesas.
No d uce d Bree d no g C isto h O vapr eu m
Devido ao problema da variação da potência das pituitárias, alternativas foram tentadas. Tentativas foram feitas em vários países para usar os análogos dos hormônios luteinizantes - hormônios liberadores (LH-RH) para a criação induzida de peixes com vários graus de sucesso. Contudo, o sucesso alcançado com LH-RH nem sempre foi consistente, além de sua necessidade de dose mais elevada para a indução da desova. Essa época de investigação pavimentou o caminho para o desenvolvimento de tecnologia simples e eficaz para a reprodução induzida da maioria dos peixes cultiváveis. Em um projeto colaborativo conjunto, financiado pelo International Development Research Centre, Canadá para o Dr. Lin da China e o Dr. Peter do Canadá, uma série de investigações foram realizadas para desenvolver uma tecnologia confiável para a criação de peixes. Suas investigações levaram ao desenvolvimento de uma nova técnica chamada método de ‘LNPE’, em que um análogo de LH-RH é combinado com um antagonista de dopamina. Com base no princípio, M / s Syndel Laboratories Limited, O Canadá fabricou um novo medicamento denominado ovaprim.
Ovaprim é um produto pronto a usar e a solução é estável à temperatura ambiente. Ele contém um análogo de 20 µg de hormônio liberador de gonadotrofina de salmão (sGnPHa) e um antagonsista de dopamina, domperidona a 10 mg / ml. A potência do ovaprim é uniforme e contém sGnRHa, que é conhecido por ser 17 vezes mais potente do que o LH-RH (Peter, 1987). O antagonista da dopamina, a domperidona usada em ovaprim também é relatada como melhor do que outro antogonista comumente usado, pimozida. Ovaprim sendo um produto pronto para uso e que não requer armazenamento refrigerado, parece ser o agente de ovulação mais conveniente e eficaz.
Este medicamento é administrado a peixes reprodutores fêmeas e machos simultaneamente em uma única dose, ao contrário do extrato de hipófise, que é administrado em duas doses divididas. Isso reduz não apenas o manuseio dos peixes reprodutores, mas também ajuda a economizar tempo e trabalho consideráveis, o que aumentará o custo de produção de sementes. A resposta de desova em espécies tratadas é superior à das espécies injetadas com extrato hipofisário.
A eficiência do ovaprim para reprodução induzida de carpas deu resultados altamente encorajadores em catla, rohu, mrigal, carpa prateada, carpa capim, cabeça grande, etc. A dose efetiva necessária para várias espécies de carpas varia consideravelmente. The common dose for all carps is 0.10-0.20 ml ovaprim/kg body weight of males and 0.25-0.80 ml ovaprim/kg body weight of females. Female catla is found to respond positively for a dose range of between 0.4-0.5 ml/kg, while rohu and mrigal respond to lower doses of 0.35 ml/kg and 0.25 ml/kg respectively. Among exotic carps, silver carp and grass carp are bred at doses ranging between 0.40-0.60 ml/kg. Big head carp bred successfully at 0.50 ml/ kg. For males of Indian carps, 0.10-0.15 ml/kg and for exotic male carps 0.15-0.20 ml/kg of dosages are found to be optimum. The method of injection is the same as pituitary.
In many countries including our country, ovaprim is used on a large scale for induced breeding of all cultivable fishes successfully. Na Índia, initial trials were conducted during 1988 in Karnataka, Andhra Pradesh and Tamil Nadu.
Ovaprim has unique advantages over pituitary hormone – ready to use liquid form in 10 ml vial, consistent potency and reliable results, long shelf life, and can be stored at room temperature, formulated to prevent over dosing, male and female can be injected only once simultaneously, reduces handling and post breeding mortality, repeated spawning possible later in the season and high percentage of eggs, fertilization and hatching.
No d uce d br e edin g C eu t h o vati d e
Ovatide is an indigenous, cost-effective and new hormonal formulation for induced breeding of fishes. The new formulation is having the base of a synthetic peptide which is structurally related to the naturally occuring hormone, goanadotropin releasing hormone (GnRH). GnRH is not a steroidal hormone and belongs to the class of organic substances called peptides. It is presented as a low viscosity injectable solution which is not only highly active but also cost-effective compared to other commercially available spawning agents. It is also effective in breeding major carps and catfishes. The doses for females are 0.20-0.40 ml/kg for rohu and mrigal, 0.40-0.50 ml/kg for catla, silver carp and grass carp and 0.20-0.30 ml/kg for calbasu. The dosages for males are 0.10-0.20 ml/kg for rohu, mrigal and calbasu, 0.20-0.30 ml/ kg for catla and 0.20-0.25 ml/kg for silver carp and grass carp.
The advantages of ovatide are:It is cost-effective hormonal preparation, it gives high fertilisation and hatching percentage (85-95%), it is increases egg production through complete spawning, it produces healthy seed, it is easy to inject due to its low viscosity, it does not cause adverse effects on brood fish after injection, it can be administered in a single dose to brooders, it can be stored at room temperature, it is quite effective even under climatic adversities and ovatide is available in the market as 10 ml vial, which costs Rs. 300. It is cheaper than ovaprim. The selection of brooders and injecting methods are similar to pituitary extract.
Ind você ce d B reedin g sagacidade h Ovop e eu
Ovopel, developed by the University of Godollo in Hungary, is a preparation containing mammalian GnRH and the water-soluble dopamine receptor antagonist, metoclopramide. The concentration of D-Ala6, Pro9NEt-mGnRH and metoclopramide are in the form of 18-20 micro gm/pellets and 8-10mg/pellets respectively. The hormone is thus available in pellet form. Each pellet contains superactive gonadoptropin releasing hypothalamic hormone analogue with an equal effect which a 3 mg normal acetone-dried dehydrated carp hypophysis gland has. Induced propagation of fish had been shown to be more effective if the hormone was administered in two doses, prime dose and resolving dose, as reported by Szabo, T., 1996. For cyprinids successful results were reported when 2-2.5 pellets/kg were administered to female brood fish. Contudo, preliminary trial with single injection of Ovopel gave encouraging result on a few species of Indian major carps and Clarias batrachus.
The required amount of ovopel was calculated on the basis of weight and condition of brood fish. The pellets were pulverized in a mortar and dissolved in distilled water. The trails were conducted in July-August of 1999.
The new inducing agent. ovopel is easy to store, simple to use and less expensive, as reported by Szabo. T, 1996. However, na Índia, detailed studies to establish its efficacy and economic viability are required to be undertaken. The hormone has been successfully tested for ovulation in several species of cyprinids, the Common carp, the Silver carp and the tench (Horvath et al, 1997) in Europe. Ovulation was also reported in African Cat fish (Brzuska, E. 1998). Na Índia, Ovopel was used with success in induced breeding of major carps in UP, Haryana and Punjab. In Assam the trials conducted recently on Labeo rohita (Rohu), Cirrihinus mrigala (Mrigal), Labeo gonius (Gonius) and Clarias batrachus (Magur) gave encouraging results. This indicates the possibility of using this new hormone preparation for commercial production of fish seeds if made available to farmers at a competitive price.
O t ele r Su b sta n ce s nós e d f o r eu n duc e d B r ee d no g
Other substances like LH-RH analogues, steroids, and clomiphene are used for induced breeding of fishes.
LH-R H analo g ue :
Various analogues of Luteinizing hormone -releasing hormone (LH-RH) have been used for induced breeding of fishes. Investigations have revealed that the potential action of releasing hormone when dopamine antagonist is simultaneously used with the analogues is (10-100 µg/kg) used successfully in China. An analogue of teleost GNRH is found to be more potent than LH-RH. GNRH (Gonadotropin releasing hormone) stimulates GTH(Gonadotropin hormone) in teleosts (dosage 25-100 µg/kg).
S t e roids:
Selected steroid hormones are used to induce fish. The effects of steroid hormones on ovulation are seen primarily as germinal vesicle breakdown (GVBD). Ovulated oocytes require at least 4 hours to become fertilisable in mullets, whereas in most of the fishes oocytes are fertilisable immediately. The action of pituitary gonadotropins on oocyte maturation is known to be mediated through steroid hormones. Deoxycorticosterone acetate (DOCA) and cortisone effectively stimulate (dosage 50 mg/kg of fish) ovulation in Heteropneustes fossilis (Goswamy and Sunderraj, 1971). 17á-hydroxy-20B dihydroprogesterone (17á-20BDP) is useful to induce gold fish, trout and pikes (Jalabert, 1973). Other steroid hormones commonly used for spawning teleosts are cortisone acetate, deoxycortisol, deoxycorticosterone, hydroxycortisone, progesterone, 11 deoxycorticosterone and 20B progesteron. The advantages of steroids are:most compounds are available as pure preparations in synthetic forms, the quality of steroid preparations is uniform and steroid hormones are much cheaper than gonadotropin preparations.
Cl o miph e ne :
It is an analogue of the synthetic non-steroidal estrogen chlorotrianisene. It is known to have antiestrogenic effects in teleosts. It triggers the release of gonadotropins. The injections of clomiphene (10 µg/g) induced ovulation within 4 days in gold fish, whereas with same dosage, common carp spawned successfully after 40-64 hours.
E s t eu m uma t eu o n o f E g g s :
The eggs are collected from the hapa by means of cup or tray or beaker and transferred to the buckets. The breeders are also removed from the hapa and their weights areoted. The difference in weights reveals approximately the number of eggs laid. The eggs are kept in a rectangular piece of close meshed mosquito net and allow the water to drain off. The eggs are measured in a beaker, mug or cup of known volume and transferred to hatcheries. Thus estimation of total quantity is made from total volume of the eggs measured. Percentage of fertilization can be arrived at by counting the number of fertilized eggs from egg samples of 1 ml measure.
B r ead eu n g o f C o m mo n c ar p :
Common carp (Cyprinus carpio) generally breeds in confined water. Spawning takes place in shallow marginal, weed infected areas from January to March and from July to August. Common Carp is also observed to breed round the year. Controlled breeding of common carp is conducted to achieve better spawning and hatching. A set of selected brooders one female and two males are put together in breeding hapa. In order to ensure successful spawning sometimes the female fish is injected with pituitary gland extract at a low dose 2 to 3 mg per kg. Body weight. Freshly washed aquatic weeds (Hydrilla, Najas, Eichhornia etc) are uniformly distributed inside the hapa. These aquatic weeds act as egg collections. The quantity of weed used is roughly double the weight of the female introduced. Each weed attached with 40, 000 para 1, 00, 000 eggs are distributed into a single hatching hapa. After 4 or 5 days the weeds are taken out carefully.












