Esta semana, John Marble escreve sobre a economia de adicionar fertilizantes a pastagens, então pensamos que era um bom momento para examinar mais de perto o nitrogênio e os fertilizantes. Esta peça foi inspirada por algumas informações que John forneceu sobre nitrogênio e seus possíveis impactos.
Um pouco de histórico

Em seu discurso inaugural em 1898 como presidente da Associação Britânica para o Avanço da Ciência, o renomado químico Sir William Crookes fez uma previsão terrível:os povos comedores de trigo do mundo começariam a ficar sem comida na década de 1930. A razão – uma escassez de fertilizante de nitrogênio.
O nitrogênio é um nutriente crítico para as plantas e os agricultores da época usavam nitrogênio na forma de amônia do guano enviado da América do Sul para melhorar o rendimento das colheitas. Mas o guano era um recurso limitado, então Crookes pediu aos cientistas que encontrassem outra solução.

Como o nitrogênio compõe cerca de 78% da atmosfera da Terra, o cientista alemão Fritz Haber se concentrou em um método para extrair nitrogênio do ar. Ele e seu assistente, Robert le Rossignol, desenvolveram uma maneira de catalisar a amônia a partir do hidrogênio e do nitrogênio atmosférico. Carl Bosch, um cientista da BASF, ampliou a máquina de mesa de Haber para produção em nível industrial, e o processo Haber-Bosch nasceu. Em 1913, uma fábrica alemã produzia 20 toneladas de fertilizante por dia usando esse processo.
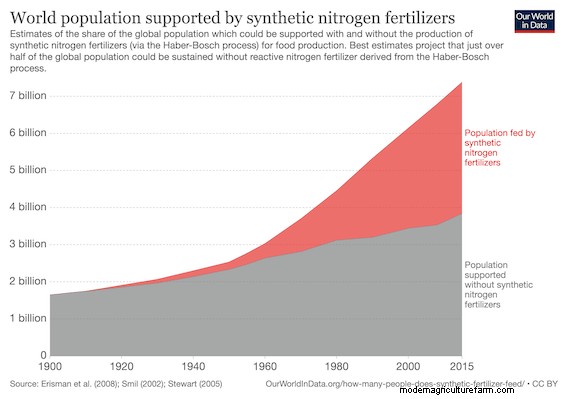
O processo Haber-Bosch fez exatamente o que William Crookes esperava e muito mais. Na verdade, estima-se que cerca de metade da população global seja sustentada por fertilizantes sintéticos. São 3 a 3,5 bilhões de pessoas alimentadas graças ao processo Haber-Bosch.
O Bom
Hoje, utilizamos o nitrogênio da atmosfera e o hidrogênio do metano do gás natural para produzir fertilizantes químicos. Isso significa que o preço do fertilizante sobe e desce com o preço do gás natural. Também costumamos combinar nitrogênio com outros nutrientes como fósforo, potássio ou enxofre, nutrientes que podem faltar nos solos.
Com a fertilização adequada, os rendimentos das colheitas geralmente aumentam de 30 a 50 por cento em relação ao que os agricultores teriam obtido de outra forma. Os rendimentos das pastagens também podem aumentar. Pesquisas em Iowa mostraram que a produção de capim, medida em termos de forragem seca, dias de pastejo por vaca ou ganhos de peso vivo de novilhos de um ano, pode ser aumentada duas a três vezes ou mais com a fertilização adequada de N.
Se você optar por fertilizar ou não, dependerá da necessidade de forragem adicional, do conteúdo de leguminosas, do manejo e da relação custo-benefício. Para saber mais sobre custo versus lucro, confira o artigo de John esta semana. Para saber mais sobre como, quando e por que aplicar fertilizantes, confira esta série de duas partes:
O mau e o feio
Quando espalhamos fertilizantes de qualquer tipo em um pasto ou campo de feno, uma parte do N pode volatilizar (evaporar). Sob boas condições, a maior parte do N é absorvida pelo solo, onde os microrganismos do solo o convertem em uma forma que as plantas podem usar. Mas o nitrogênio também pode ser perdido devido ao escoamento e à erosão, aumentando a ameaça das moléculas de N encontrarem seu caminho para as águas superficiais, onde causam problemas para os sistemas biológicos. O nitrogênio também pode penetrar no abastecimento de água subterrânea, criando uma ameaça aguda à saúde pública em alguns lugares.
Adicionar nitrogênio aos seus solos também pode desencorajar as leguminosas em suas pastagens de fixarem nitrogênio naturalmente. Afinal, por que fazer todo esse trabalho se já existe bastante nitrogênio livre disponível no solo? Adubar com Nitrogênio também aumenta a possibilidade de excesso de Nitratos em sua forragem. Finalmente, dependendo do tipo de solo, a adição de fertilizante químico de nitrogênio pode reduzir o pH do solo, tornando-o mais ácido com o passar do tempo. De fato, em áreas onde os solos não são suficientemente ácidos, uma das prescrições pode ser adubar.
O fertilizante químico mata os micróbios do solo?
O mito de que fertilizantes sintéticos matam micróbios ganhou muito destaque ultimamente. A realidade é exatamente o oposto, então vamos dar uma olhada no que sabemos sobre como as coisas funcionam.
Primeiro, não há diferença química entre uma molécula de nitrato de uma fonte orgânica de nitrogênio e uma molécula de nitrato de um saco de fertilizante sintético. Os laboratórios não podem dizer a diferença, nem as plantas. O que torna o fertilizante orgânico diferente é sua baixa taxa de liberação em comparação com o fertilizante sintético, que fica disponível assim que o fertilizante se dissolve na água.
Essa liberação rápida de nutrientes poderia ser perigosa? Quando
os pesquisadores realizaram testes eles descobriram que a adição de fertilizante sintético não resultou em alteração no número de bactérias ou fungos, enquanto o fertilizante orgânico mostrou um ligeiro aumento em ambos. Além disso,
um estudo de dez anos observar a diferença mostrou que, quando aplicado adequadamente, o nitrogênio teve efeitos mínimos nos micróbios do solo, nas propriedades bioquímicas do solo ou na estrutura do solo.

Dr. Ray Wiel é o autor de
A Natureza e as Propriedades dos Solos o texto de marca nos solos. Ele nos diz:“A maioria dos fertilizantes realmente estimula o crescimento microbiano, seja porque fornecem os nutrientes de que os micróbios precisam ou, mais frequentemente, porque estimulam o crescimento das plantas, e a planta estimula os micróbios”.
Ele acrescenta:“A principal situação em que os fertilizantes realmente matam os micróbios é a amônia anidra injetada no solo em faixas”. Enquanto o solo é bastante esterilizado em uma área de duas ou três polegadas de diâmetro ao redor do local da injeção, os micróbios rapidamente recolonizam uma vez que o gás amônia se dissipa ou se dissolve na água, então se torna amônio e é absorvido pelas plantas.
Mas e os sais em fertilizantes sintéticos?
Aqui é onde a linguagem dos químicos e a linguagem do resto de nós leva à confusão. Para um químico, um sal é um composto formado por dois ou mais íons. O sal de mesa, ou cloreto de sódio, é composto de íons de sódio e cloro. O fertilizante de nitrato de amônio é composto de íons de amônio e nitrato, então eles também o chamam de “sal”.
Mas os íons desse tipo de sal se comportam de maneira diferente do cloreto de sódio. Quando chove depois de aplicar o fertilizante, a água dissolve o fertilizante em íons e os lava no solo. Os íons não prejudicam micróbios ou plantas, mas são os alimentos que absorvem. O processo é o mesmo para fertilizantes orgânicos, como composto e estrume. O processo é apenas mais longo porque as proteínas e carboidratos maiores precisam se decompor e se converter em íons – exatamente os mesmos íons que o fertilizante produz.
Você pode não ter pensado que precisava saber tudo isso sobre nitrogênio e fertilizantes, mas agora que sabe, você pode usar essas informações para tomar melhores decisões sobre aplicações de fertilizantes ou impressionar seus amigos e colegas com algumas curiosidades interessantes. 🙂


 Como o nitrogênio compõe cerca de 78% da atmosfera da Terra, o cientista alemão Fritz Haber se concentrou em um método para extrair nitrogênio do ar. Ele e seu assistente, Robert le Rossignol, desenvolveram uma maneira de catalisar a amônia a partir do hidrogênio e do nitrogênio atmosférico. Carl Bosch, um cientista da BASF, ampliou a máquina de mesa de Haber para produção em nível industrial, e o processo Haber-Bosch nasceu. Em 1913, uma fábrica alemã produzia 20 toneladas de fertilizante por dia usando esse processo.
Como o nitrogênio compõe cerca de 78% da atmosfera da Terra, o cientista alemão Fritz Haber se concentrou em um método para extrair nitrogênio do ar. Ele e seu assistente, Robert le Rossignol, desenvolveram uma maneira de catalisar a amônia a partir do hidrogênio e do nitrogênio atmosférico. Carl Bosch, um cientista da BASF, ampliou a máquina de mesa de Haber para produção em nível industrial, e o processo Haber-Bosch nasceu. Em 1913, uma fábrica alemã produzia 20 toneladas de fertilizante por dia usando esse processo. 
 Dr. Ray Wiel é o autor de A Natureza e as Propriedades dos Solos o texto de marca nos solos. Ele nos diz:“A maioria dos fertilizantes realmente estimula o crescimento microbiano, seja porque fornecem os nutrientes de que os micróbios precisam ou, mais frequentemente, porque estimulam o crescimento das plantas, e a planta estimula os micróbios”.
Dr. Ray Wiel é o autor de A Natureza e as Propriedades dos Solos o texto de marca nos solos. Ele nos diz:“A maioria dos fertilizantes realmente estimula o crescimento microbiano, seja porque fornecem os nutrientes de que os micróbios precisam ou, mais frequentemente, porque estimulam o crescimento das plantas, e a planta estimula os micróbios”. 


